Publié : mai 2024
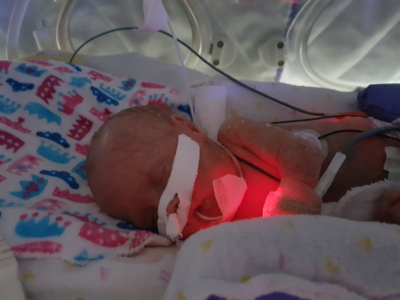
Emmy Cogan était microprématurée à sa venue au monde, mais sa naissance a eu une portée considérable. Née à 23 semaines de grossesse, elle pesait seulement 515 grammes, soit à peine plus d’une livre. Emmy figure parmi les neuf bébés inscrits au tout premier essai clinique au monde d’une thérapie cellulaire visant à guérir les poumons de prématurés et a été la première à la recevoir en Amérique du Nord. Cet essai prometteur est aujourd’hui prêt à passer à la phase suivante.
Son arrivée précoce est survenue peu de temps après le retour d’un voyage à Hawaï d’Alicia Racine et de Mike Cogan, qui sont ainsi devenus parents pour la première fois. Alicia était à son poste de répartitrice des appels logés au 911 du Service de police d’Ottawa lorsqu’elle a perdu les eaux.
« Ma sœur travaille avec moi et c’est elle qui m’a emmenée au Campus Général de L’Hôpital d’Ottawa. J’avais énormément de douleur et je ne savais pas vraiment ce qui m’arrivait. Nous avons ensuite découvert que j’avais des contractions et que mon col avait commencé à se dilater », explique Alicia.
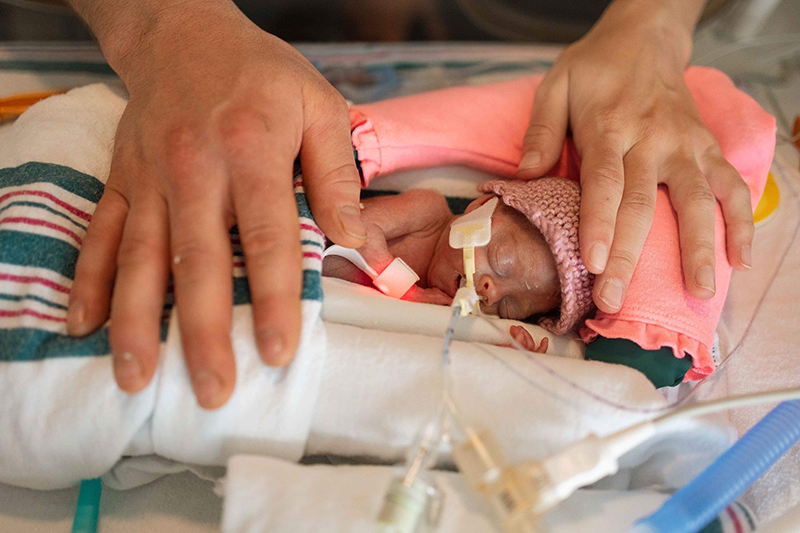
Le bébé a tenu six jours de plus avant de naître le 20 février 2023. Ces quelques jours supplémentaires dans l’utérus ont été essentiels pour donner à Emmy une chance de vivre. « Ils ont complètement changé la donne pour nous et pour elle. Elle a pu être intubée et elle a commencé à se battre à partir de ce moment-là », précise Mike.
Des problèmes de santé à l’horizon
Emmy a d’abord été prise en charge à l’Unité de soins intensifs néonataux de L’Hôpital d’Ottawa, puis elle a été 10 jours au CHEO avant de revenir à L’Hôpital d’Ottawa.
Emmy a relevé bien des défis qui compromettaient le pronostic vital pendant son premier mois de vie. Un canal entre le cœur et les poumons ne se fermait pas et des problèmes gastro-intestinaux ont provoqué une sepsie (infection du sang), ce qui a entraîné bien des inquiétudes. Il a ensuite été possible de l’extuber et de lui offrir une oxygénothérapie à haut débit. « Nous avons pu la tenir dans nos bras pour la première fois à ce moment-là et mes parents ont pu être présents, ce qui était vraiment touchant », ajoute Mike.

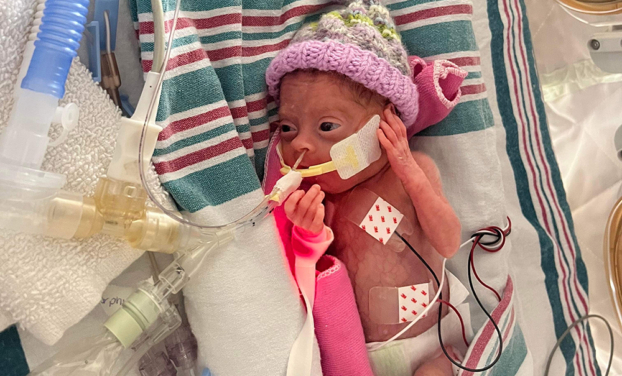
Emmy a aussi souffert de dysplasie bronchopulmonaire (DBP). Cette maladie touche bien des prématurés parce qu’ils naissent avant l’achèvement de la formation des poumons. Ils ont ainsi besoin d’oxygène pour parvenir à respirer, mais l’administration de cet oxygène – pourtant essentiel à leur survie – peut toutefois endommager leurs minuscules poumons. C’est un peu comme s’ils étaient atteints d’emphysème dès la naissance.
Les répercussions dévastatrices de la DBP
Au Canada, 1 000 bébés reçoivent un diagnostic de DBP chaque année. Le nombre grimpe à environ 150 000 à l’échelle mondiale. Bien souvent, ces bébés présentent d’autres maladies pulmonaires chroniques comme l’asthme et peuvent avoir besoin d’un apport prolongé en oxygène et de ventilation.
Ces bébés présentent aussi un taux élevé de réadmission à l’hôpital pendant les deux premières années de vie, en plus d’avoir souvent des problèmes à d’autres organes comme le cerveau ou les yeux. Il n’existe aucun traitement contre cette maladie, mais ce tout premier essai clinique au monde mené par le Dr Bernard Thébaud, scientifique principal et néonatologiste, est porteur d’espoir.
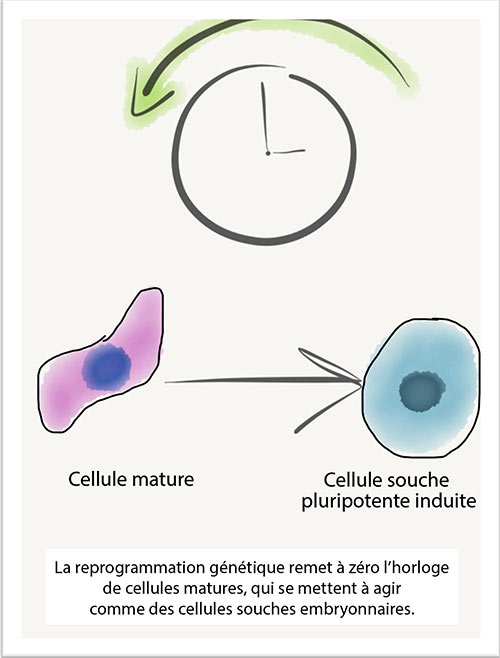
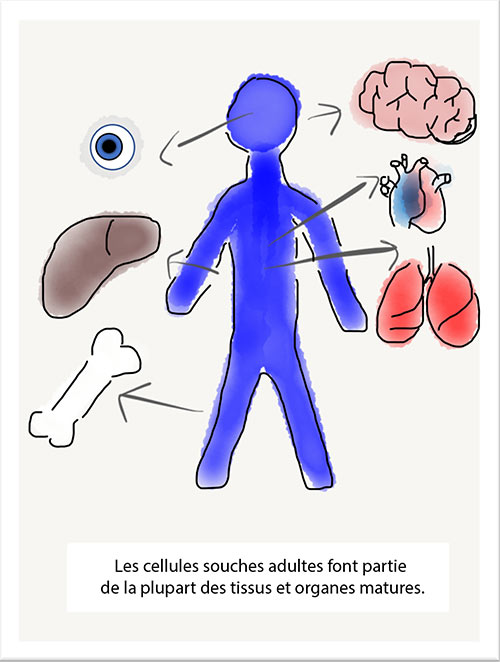
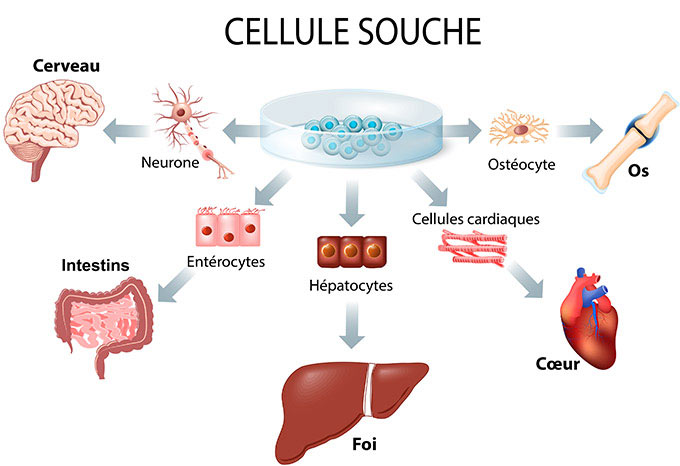
Il y a deux décennies, l’équipe du Dr Thébaud a découvert que les cellules souches de cordons ombilicaux – appelées cellules stromales mésenchymateuses (CSM) – pouvaient guérir des lésions pulmonaires et prévenir la DBP chez des bébés rongeurs. Depuis lors, l’équipe a travaillé sans relâche ici, à Ottawa, et en collaboration avec des scientifiques des quatre coins du monde pour offrir cette nouvelle thérapie à des bébés et à leur famille dans le cadre d’essais cliniques. Le traitement de la DBP chez les prématurés par CSM a déjà fait l’objet d’essais cliniques, mais aucun groupe n’a utilisé de CSM prélevées sur l’ensemble du cordon ombilical de la façon préconisée par l’équipe du Dr Thébaud.
Qu’est-ce que la dysplasie bronchopulmonaire?
« Dans le cadre de la recherche sur les rongeurs, nous avons misé sur des cellules souches isolées du cordon ombilical de nouveau-nés en santé pour prévenir des lésions pulmonaires ou même, dans une certaine mesure, régénérer des cellules pulmonaires endommagées, explique le Dr Thébaud. Nous pensons que l’administration de ces cellules souches à un certain moment de l’hospitalisation des bébés pourrait prévenir la progression de la maladie. »
Peu après la naissance d’Emmy, ses parents ont rencontré Chantal Horth, coordonnatrice d’essais cliniques, puis le Dr Thébaud. « Chantal nous a informés qu’Emmy était admissible à l’essai, se souvient Mike. L’essai semblait être une possibilité prometteuse. »
« En raison de sa prématurité, Emmy va avoir des problèmes de santé. Nous voulons lui donner la chance de bénéficier de tout ce qui peut lui venir en aide. »
— Alicia Racine
Accepter la participation à une première mondiale
Le couple a rencontré le Dr Thébaud, qui a répondu à une longue liste de questions au sujet de l’essai. « C’est un homme très sympathique avec qui il est très facile de discuter. Nous lui avons fait confiance. En raison de sa prématurité, Emmy va avoir des problèmes de santé. Nous voulons lui donner la chance de bénéficier de tout ce qui peut lui venir en aide », ajoute Alicia.
Pour être admissibles à l’essai, les prématurés – nés à 23 ou 24 semaines de grossesse à L’Hôpital d’Ottawa – devaient avoir entre 7 et 21 jours, recevoir des soins intensifs néonataux et avoir besoin de 35 % d’oxygène. Une oxygénothérapie de cette ampleur entraîne un risque de DBP qui varie entre 60 % et 70 %. Le Centre Sunnybrook des sciences de la santé a aussi recruté un bébé et est ainsi devenu le deuxième établissement mobilisé.
Le 3 mars 2023 à 11 jours, Emmy a reçu une perfusion intraveineuse de cellules de cordons ombilicaux donnés par les parents de nouveau-nés en santé. Ce fut un moment particulier pour toutes les personnes concernées. Elle a été le premier bébé en Amérique du Nord à recevoir ce type de thérapie.
« C’est le premier essai clinique du genre au monde et rien n’est plus valorisant que d’aider un prématuré. »
– Dr Bernard Thébaud
« Le Dr Thébaud a administré les cellules, puis tout le monde a applaudi, poursuit Mike. Elle aura des rendez-vous de suivi à différentes étapes pendant deux ans, puis il y aura un suivi par téléphone pendant 10 ans. »
Ce moment était la concrétisation d’un rêve pour le Dr Thébaud et son équipe. « Cette journée marquait une étape incroyablement palpitante et d’envergure considérable. Après 20 années de travail, nous pouvions enfin tester cette thérapie pour la première fois chez un patient. C’est le premier essai clinique du genre au monde et rien n’est plus valorisant que d’aider un prématuré. »
La prochaine étape de l’essai clinique
Grâce à ces neuf petits patients, dont Emmy, le recrutement pour l’essai de phase 1 est maintenant terminé. Son objectif est de tester la faisabilité et la sécurité de la thérapie par cellules souches. La phase suivante portera sur la sécurité et l’efficacité de la thérapie.
« Toutes les étoiles se sont alignées pour qu’elle fasse partie d’un moment historique qui recèle le potentiel d’améliorer l’avenir des bébés prématurés. »
– Alicia Racine

« Nous pouvons maintenant déterminer si la thérapie aidera véritablement les patients, précise le Dr Thébaud. La phase suivante inclura deux groupes, un qui recevra les cellules et l’autre qui recevra un placebo. C’est un essai à répartition aléatoire. Nous aurons besoin de 168 patients pour déterminer si ces cellules souches sont efficaces. »
Le recrutement des bébés pour la première phase a eu lieu dans les unités de soins intensifs néonataux de L’Hôpital d’Ottawa et du Centre Sunnybrook des sciences de la santé. La prochaine phase durera deux ans et consistera en un essai multicentrique à l’échelle du pays. Le Dr Thébaud espère qu’elle débutera d’ici la fin de l’année 2024.
« Travailler auprès de bébés est le plus beau métier du monde. À la naissance, ils ont toute la vie et tout un potentiel devant eux. Notre rôle est de leur donner un grand élan », ajoute le Dr Thébaud.






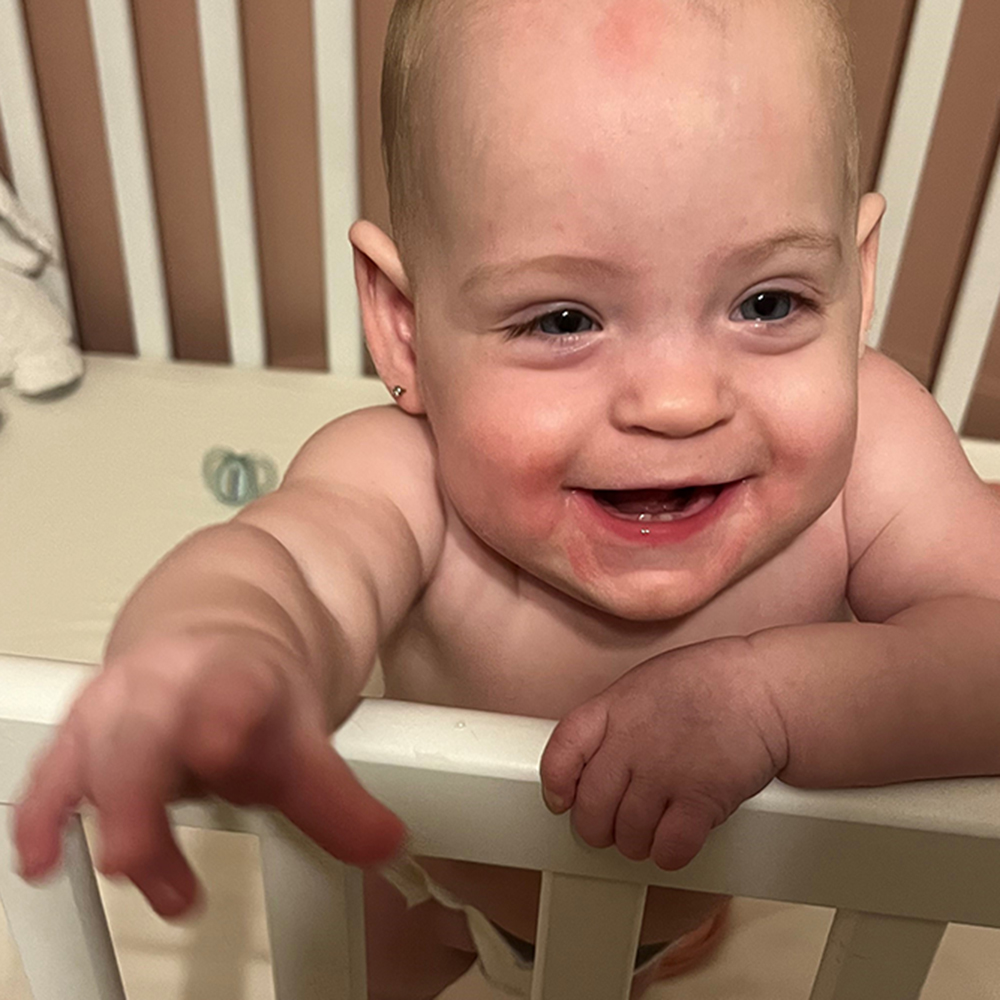
Emmy a quitté l’hôpital cinq mois après sa naissance. Mike et Alicia ne savent pas si les cellules souches lui ont véritablement donné un coup de pouce, mais Emmy se porte bien. « Nous ne savons pas dans quel état elle serait sans cet essai, mais elle est en pleine forme aujourd’hui, confie Mike. Nous nous sommes sentis très chanceux d’être au bon endroit au bon moment pour notre petite fille. »
C’est ce qui rend Emmy encore plus unique aux yeux d’Alicia. « Toutes les étoiles se sont alignées pour qu’elle fasse partie d’un moment historique qui recèle le potentiel d’améliorer l’avenir des bébés prématurés », ajoute Alicia.
C’est en tout cas ce qu’espère le Dr Thébaud. « Cela changerait la façon dont nous prenons en charge les prématurés. J’espère que ces petits patients auront une chance de s’épanouir, de grandir et d’améliorer le monde qui les entoure. »
Emmy ne sait pas qu’elle est entrée dans l’histoire, mais ce n’est pas grave. Pour l’instant, elle tient ses parents occupés. Elle se rétablit et marchera en un rien de temps. Elle n’a plus besoin d’oxygène depuis novembre 2023, ce qui lui donne encore plus de mobilité. « C’était vraiment amusant de la voir libérée de ses sondes pour la première fois! Le retrait de l’oxygène a été un immense pas en avant », affirme Mike.